Diet Research Data (試験データ集):雌雄 ICRマウスに対するQuick Fat 給与の影響
Related CLEA Japan product: Quick Fat

For the animal, please click here↓![]() : https://www.clea-japan.com/en/products/general_diet/item_d0070
: https://www.clea-japan.com/en/products/general_diet/item_d0070![]() : https://www.clea-japan.com/products/general_diet/item_d0070
: https://www.clea-japan.com/products/general_diet/item_d0070
Inquiry(お問い合わせ):
If you have any question, please feel free to contact us from here.
1.目的
高脂肪飼料(Quick Fat)の給与が、Wistarラットの肥満・インスリン抵抗性に及ぼす影響について検討しました。
2.材料および方法
(1)試験の実施場所
日本配合飼料(株)(現フィード・ワン(株))中央研究所のマウス飼育室(コンベンショナル)にて実施しました。
(2)給与飼料
- CE-2: 粗脂肪含量 4.6%、Fat kcal% 11.9%、可溶性無窒素物含量 51.4%、NFE kcal% 59.3%
- Quick Fat(以下 QF): 粗脂肪含量 13.6%、Fat kcal% 29.8%、可溶性無窒素物含量 47.8%、NFE kcal% 46.6%
(3)動物
Jcl:Wistarマウスの雌雄を 3週齢で導入し、1週間の順化後に体重を指標に対照群(CE-2給与群)と試験群(QF給与群)の 2群に分け、4週齢から 25週齢までの期間、それぞれの飼料を自由摂取させました。また供試数は、雌雄共に 1試験群あたり 8匹としました。
(4)飼育方法
- 温度と湿度:温度= 24~ 27℃、湿度= 50~ 70%
- 照明:12時間の明暗サイクル(点灯時間 9:00~ 21:00)
- ケージ:滅菌チップを入れたポリカーボネート製ケージに 1匹ずつ入れて飼育しました。
- 飼料:自由摂取としました。
- 飲水:水道水を自由摂取としました。
(5)試験方法
給与期間中は、体重・摂餌量・飲水量を毎週測定し、空腹時(20時間絶食)における尾静脈からの採血は 4、6、8、10、14、18、22週齢時に実施しました。給与期間終了後、25週齢時に経口糖負荷試験(グルコース投与量= 2g / kg体重)、を実施し、その後、各6匹について解剖しました。解剖では20時間絶食・エーテル麻酔下で後大静脈から血液を採取し、主要臓器および腹腔内脂肪組織を摘出しました。血液は血清として保存し、脂質代謝 関連指標(中性脂肪、遊離脂肪酸、総コレステロール、エステル型コレステロール、遊離コレステロール、リン脂質)の測定に用いました。尚、有意差検定は Student's t-testで実施しました。
3.結果
以下に記載しております。
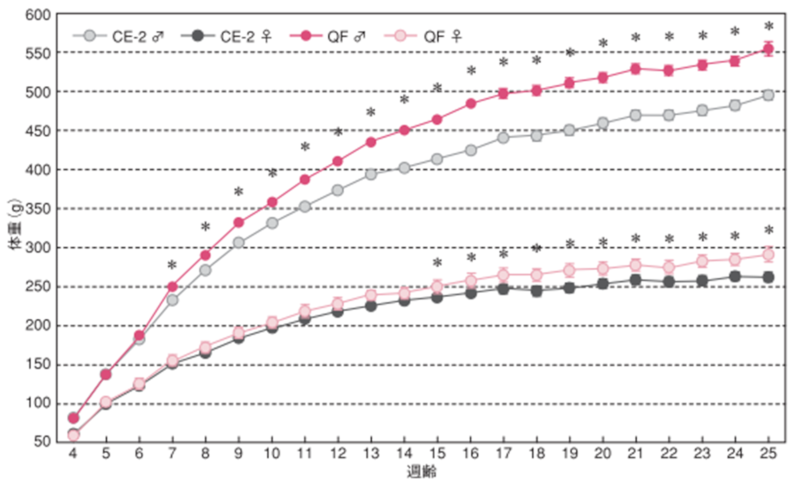
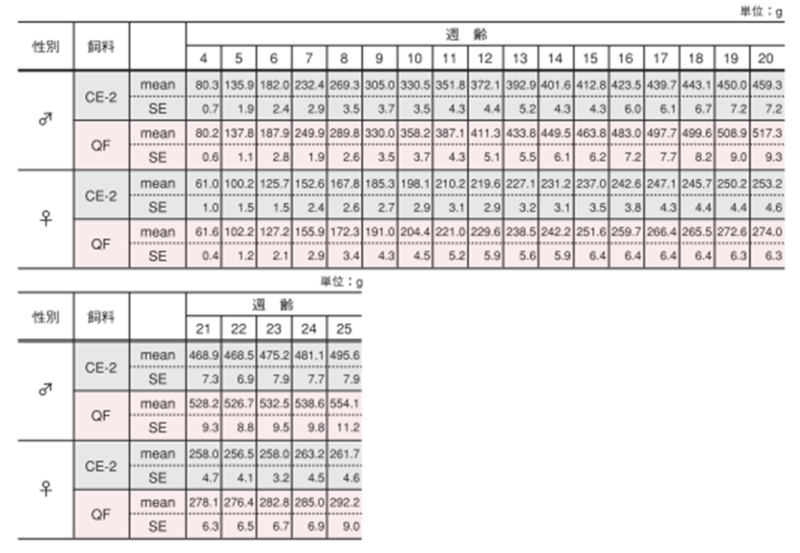
1.体重
雌雄による体重変化の違い
1週間毎に測定しました。図のポイントと縦線は平均値±標準誤差を表しています。統計処理は同性および各週齢の試験群間で実施し、図中の*は有意差があることを示しています( p< 0.05)。
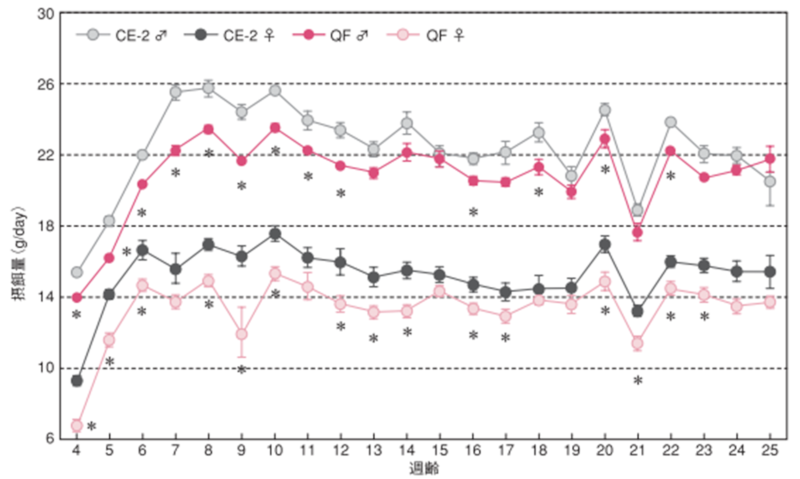
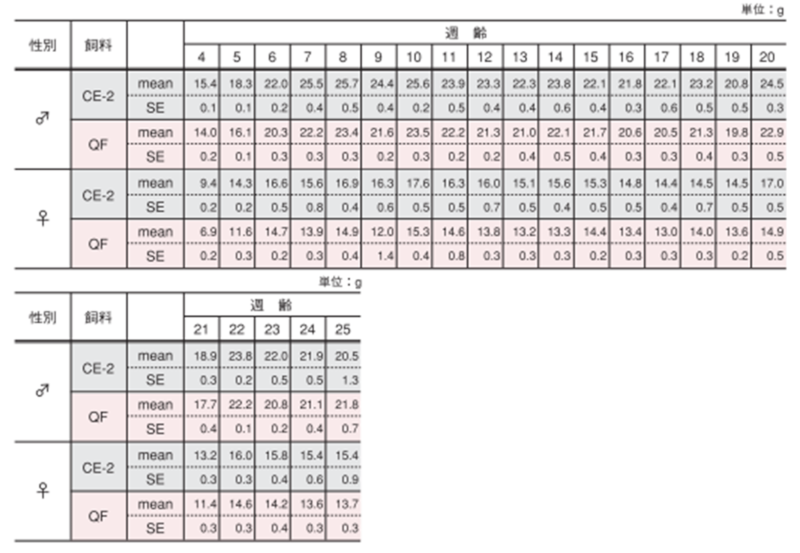
2.摂餌量・飲水量
雌雄による摂餌量変化の違い
図のポイントと縦線は平均値±標準誤差を表しています。統計処理は同性および各週齢の試験群間で実施し、図中の*は有意差があることを示しています( p< 0.05)。
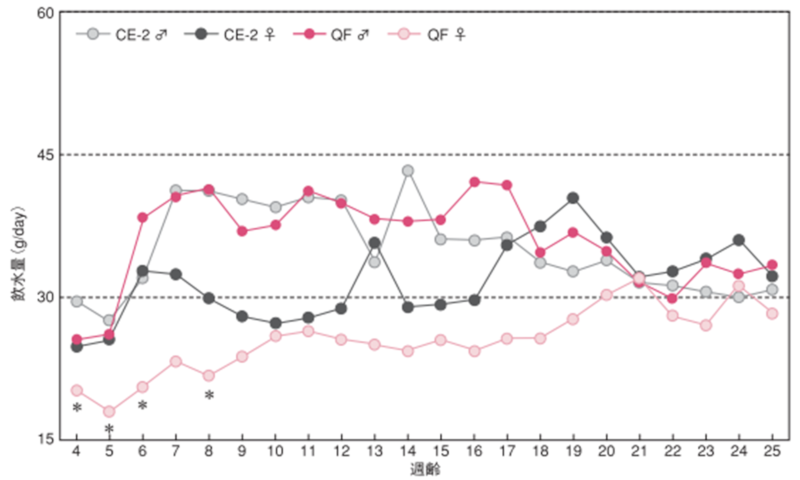
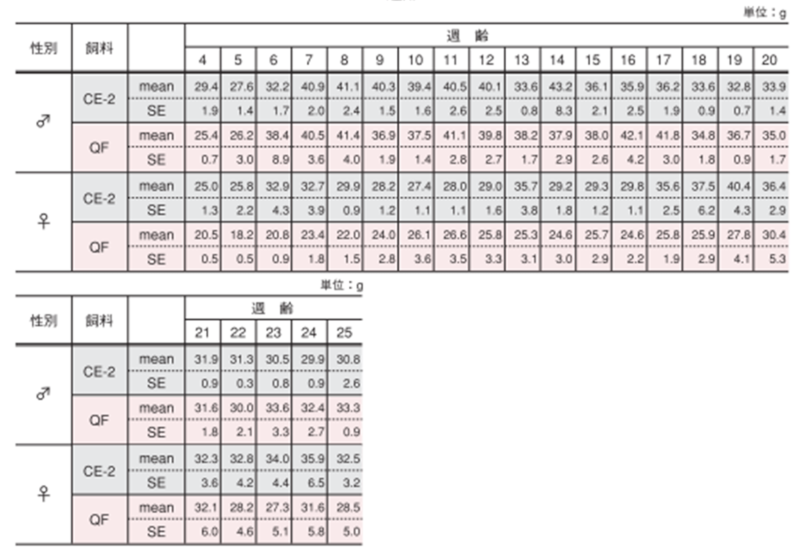
雌雄による飲水量変化の違い
図のポイントと縦線は平均値±標準誤差を表しています。統計処理は性別および各週齢の試験群間で実施し、 図中の*は有意差があることを示しています( p< 0.05)。
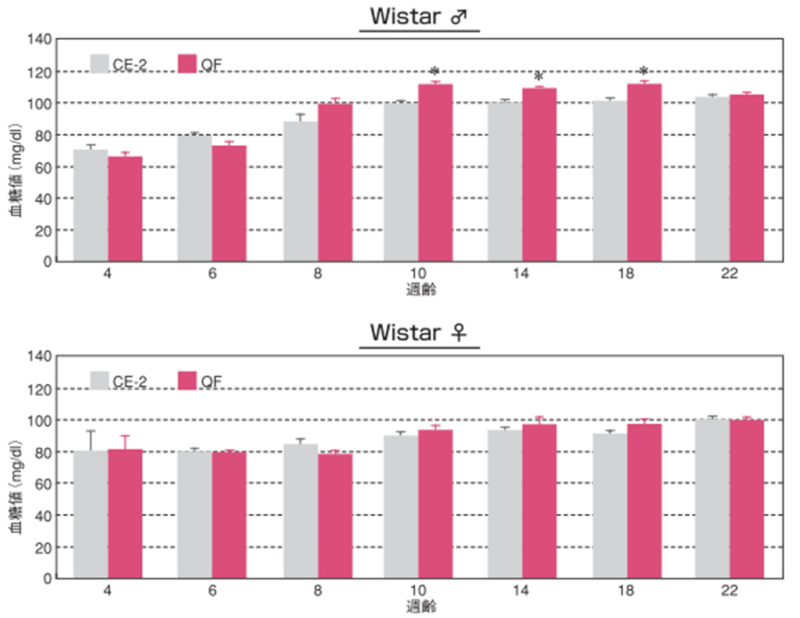
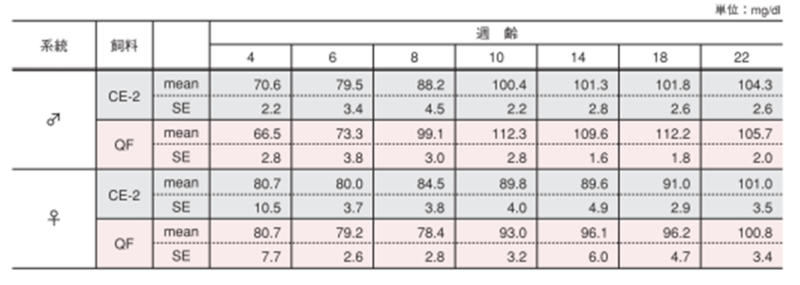
3.空腹時血糖値
雌雄による空腹時血糖値変化の違い
採血は 2週間毎に尾静脈から行い、採取の時間は点灯 4時間後の午後 1時としました。 全血を簡易血糖測定器(グルテスト PROR /(株)三和化学研究所)にて測定しました。 図の縦棒と縦線は平均値±標準誤差を表しています。統計処理は同性および各週齢の試験群間で実施し、図中の*は有意差があることを示しています( p< 0.05)。
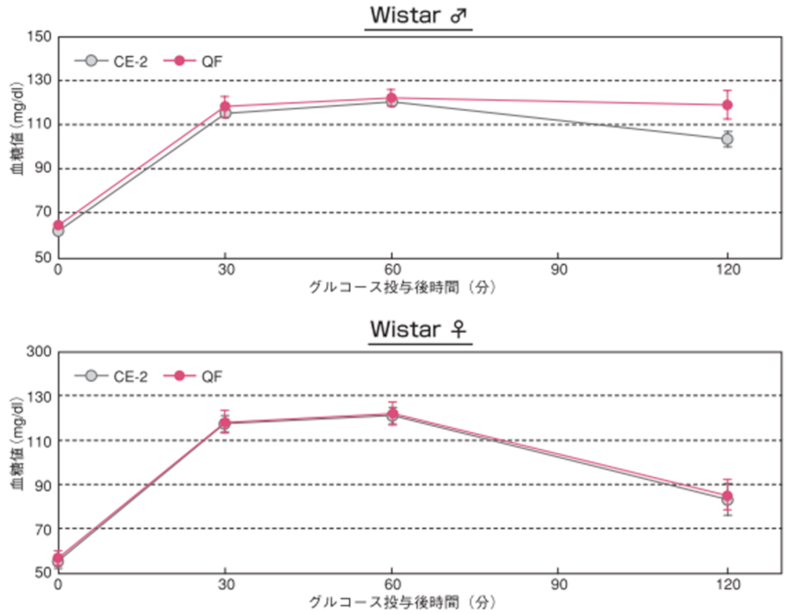
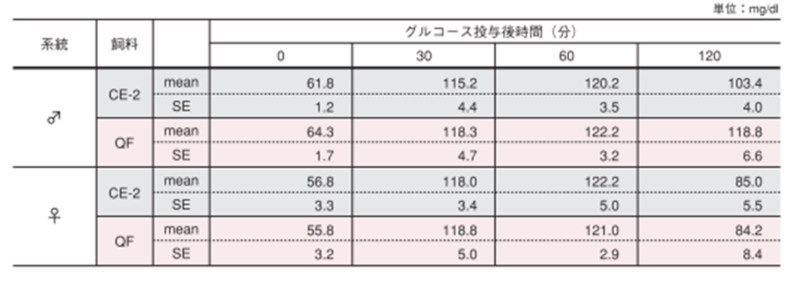
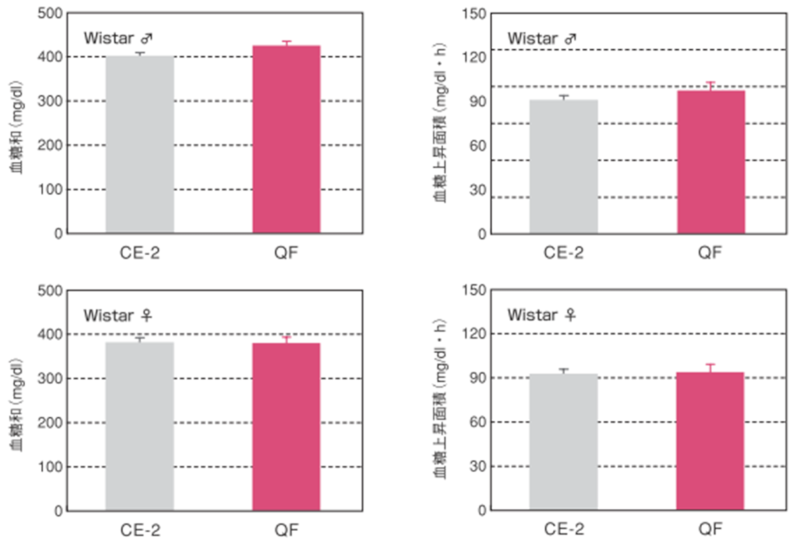
4.経口糖負荷試験
25週齢時のWistarラットにおける経口糖負荷試験結果 ̶ 1
一晩絶食(20 時間)後、グルコース溶液(2g/kg 体重)を胃ゾンデで経口投与し、投与前(0 分)、投与後 30、60、120 分に尾静脈より採血し、得られた血液は血漿として冷凍保存(-40℃)しました。血糖値はグルコース CⅡ - テストワコー(和光純薬工業(株))にて測定しました。図のポイントと縦線は平均値±標準誤差を表しています。
25週齢時の ICRマウスにおける経口糖負荷試験結果 ̶ 2
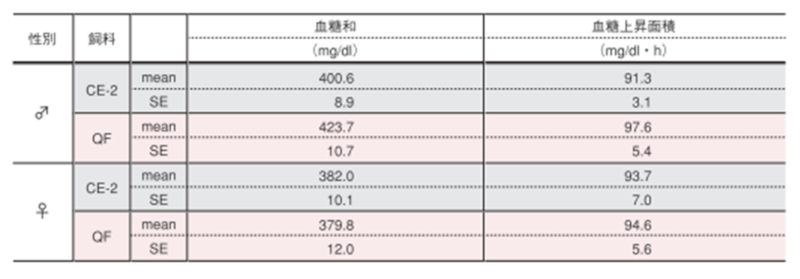
【血糖和および血糖上昇面積】
血糖和は経口糖負荷試験の各時間の血糖値の和を算出しました。血糖上昇面積は、以下の計算式により算出しました。
血糖上昇面積(mg/dl・h)={(a + 2b + 3c + 2d)×1/4}-2a
(a,b,cおよび dはそれぞれ 0,30,60および 120分後の血糖値)
図の縦棒と縦線は平均値±標準誤差を表しています。統計処理は試験群間で実施し、図中の*は有意差があることを示しています(p< 0.05)。
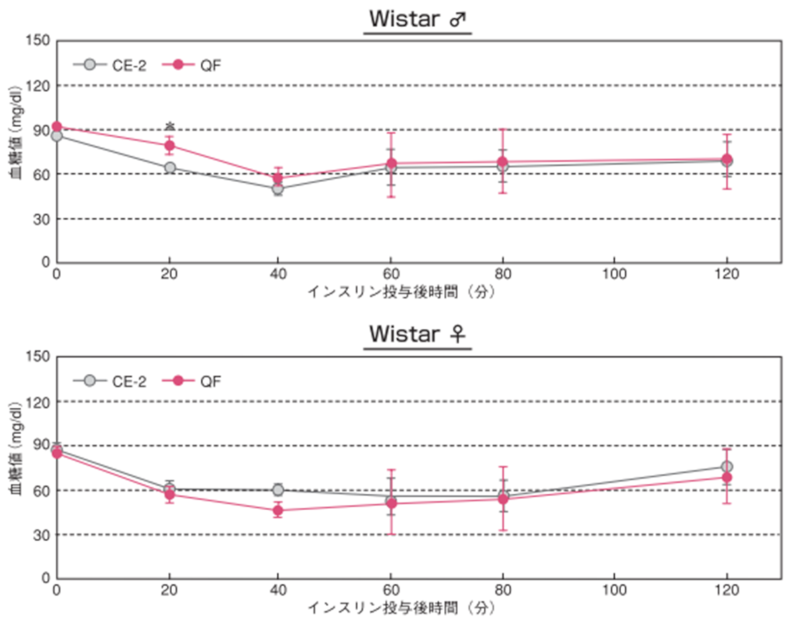
5.インスリン負荷試験
25週齢時のWistarラットにおけるインスリン負荷試験結果
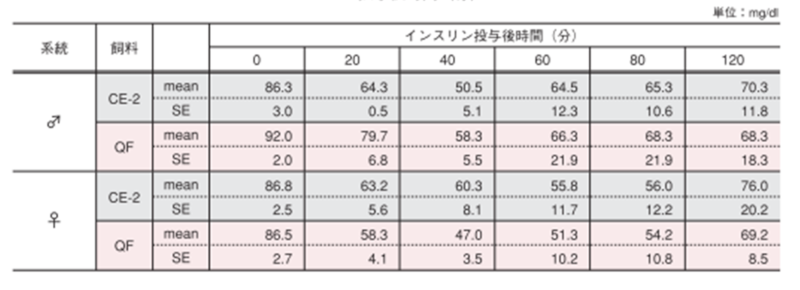
インスリン溶液(0.75IU/kg体重)を腹腔内に投与し、投与前(0.75IU/kg0分)、投与後20、40、60、80、120分に尾静脈より採血し、全血を用いて簡易血糖測定器(0.75IU/kgグルテスト PROR /(株)三和化学研究所)で血糖値を測定しました。図のポイントと縦線は平均値±標準誤差を表しています。統計処理は各時間の試験群間で実施し、図中の*は 有意差があることを示しています( p< 0.05)。
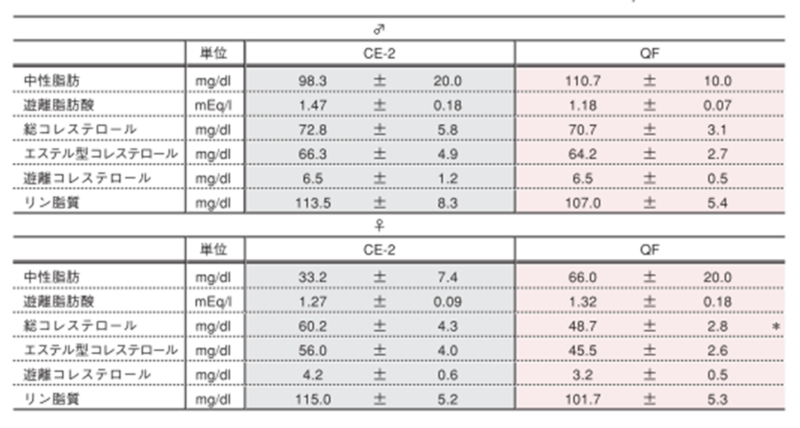
6.解剖時血液分析
解剖時の血清および血漿分析
表の値は平均値±標準誤差を表しています。25週齢時に解剖を実施し、その際に血液を採取しました。20時間絶食後エーテル麻酔下で開腹し、後大静脈から血液を採取し、血漿および血清として冷凍保存しました。統計処理は各項目の試験群間で実施し、表中の*は有意差があることを示しています( p< 0.05)。
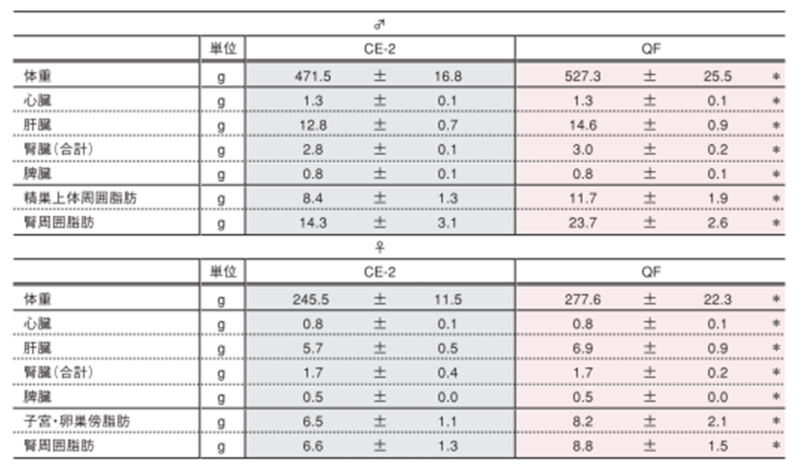
7.解剖時主要臓器重量
臓器重量
解剖時に、各臓器重量を測定しました。表の値は平均値±標準誤差を表しています。統計処理は各項目の試験群間で実施し、表中の*は有意差があることを示しています( p< 0.05)。